بحث عن الذرة
الذرة هي أدق جزء من المادة يمكن الوصول إليه عبر تقسيمها دون أن تفقد خصائصها الكيميائية المميزة. كل ذرة تعبر عن خصائص العنصر الذي تنتمي إليه، وتعتبر لبنة أساسية في علم الكيمياء. الكلمة “ذرة” في الأصل مشتقة من الكلمة اليونانية “أتوموس”، التي تعني الشيء الذي لا يمكن تقسيمه أكثر من ذلك.
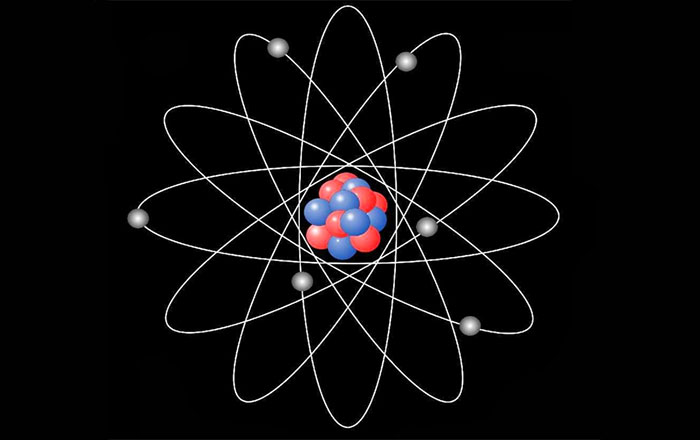
تاريخ الذرة
عبر العصور، تطورت فكرة وجود الذرة بدءًا من الفيلسوف اليوناني ديمقراط الذي طرح هذه النظرية في العام 450 قبل الميلاد، حينما اعتبر أن كل المادة تتكون من جزيئات صغيرة لا يمكن تقسيمها أكثر. بعد مرور أكثر من ألفي سنة، في العام 1800، جدد العالم الإنجليزي جون دالتون الاهتمام بنظرية الذرة من خلال تقديم براهين تدعم وجودها ومن ثم تطوير نظرية تفصيلية حولها، على الرغم من أنه أخطأ في اعتقاده بأن الذرة هي أصغر جزء في الكون.
في تطور مهم آخر، وفي العام 1897، توصل جوزيف جون طومسون إلى اكتشاف الإلكترون، ما ساعده على تقديم نموذج جديد للذرة يتضمن الإلكترونات منتشرة ضمن سحابة من الشحنات الموجبة. تتابعت الاكتشافات ففي العام 1911، أثبت العالم إرنست رذرفورد وجود النواة المركزية للذرة ومن ثم توصل لاكتشاف البروتونات، مما أدى لتحديث فهمنا لتركيب الذرة بكونها تتألف من نواة يدور حولها الإلكترونات.
تركيب الذرة
تشتمل كل ذرة على نواة مركزية تحتوي على بروتونات تحمل شحنات موجبة ونيوترونات بلا شحنة كهربائية، بينما تتواجد الإلكترونات ذات الشحنة السالبة في مدارات حول النواة. تعتبر النواة هي المركز الأكثر كثافة في الذرة وتحدد ترتيب الإلكترونات حولها الخصائص الأساسية للذرة. من المهم ملاحظة أن كل عنصر يمتلك عدد بروتونات محدد يُعرف بالعدد الذري، وهذا العدد فريد لكل عنصر ويحدد خصائصه الجوهرية.
البروتونات، التي تُعتبر جزءاً من الجسيمات الفرعية للذرة، تم اكتشافها بواسطة رذرفورد من خلال التجارب باستخدام أنابيب الأشعة المهبطية. تتألف من ثلاثة كواركات: اثنان علويان يحملان شحنة موجبة وواحد سفلي بشحنة سالبة. هذه الكواركات متصلة ببعضها بواسطة الغلوونات. من جهة أخرى، تتميز الإلكترونات بكونها جسيمات ذات شحنة سالبة وكتلة ضئيلة جداً مقارنة بالبروتونات والنيوترونات، حيث تُشكل نسبة ضئيلة جداً من كتلة البروتون.
النيوترونات، كجسيمات فرعية محايدة، تُشكل جزءاً هاماً من النواة وتربط بينها وبين البروتونات عبر القوة النووية القوية، ولها دور مؤثر في تسبب الإشعاع الذري. كما تعتبر كتلة النيوترونات قريبة جداً من كتلة البروتونات لكنها تزيد عنها بنسبة طفيفة.
أما عن تفاوت عدد البروتونات بين مختلف العناصر، فهو يحدد توزيعها في الجدول الدوري حيث يتم ترتيب العناصر تصاعدياً حسب العدد الذري، ما يؤثر على الخصائص الفيزيائية والكيميائية لكل عنصر.
أنواع الذرات
تختلف الذرات في خصائصها وتركيبها، إذ نجد الذرات المتعادلة التي تمتلك أعداداً متساوية من البروتونات في النواة والإلكترونات المحيطة بها. أما الأيونات، فهي ذرات تكتسب شحنات نتيجة زيادة أو نقصان في عدد الإلكترونات. النظائر تشترك في عدد البروتونات لكنها تتفاوت في عدد النيوترونات، ما يعني تنوعها رغم تشابهها الظاهري. الذرات المشعة تميل لإصدار إشعاع في سعيها لتحقيق الاستقرار، بينما تتميز المواد المضادة بأنها تحمل شحنات معاكسة وتتميز بقلة وجودها وضعف تأثيرها.
الخصائص الرئيسية للذرات
تُعتبر الذرات وحدات بناء العناصر وتحتوي على خصائص تحدد طرق تفاعلها وأداءها المتنوع. يلعب العدد الذري دوراً هاماً في تحديد الذرات، حيث يُظهر عدد البروتونات الموجودة في نواتها. هذا العدد يوافق أيضاً عدد الإلكترونات في حالة الذرة المستقرة، مما يجعله أساسياً في تحديد الخواص الكيميائية للذرة. على سبيل المثال، الكربون يمتلك ستة بروتونات وستة إلكترونات، بينما اليورانيوم يمتلك 92 بروتوناً وإلكتروناً.
بخلاف العدد الذري، فإنّ الكتلة الذرية تعتمد على عدد النيوترونات في النواة، وهي لا تؤثر على الخواص الكيميائية للذرة. غير أنها مهمة في تمييز النظائر المختلفة لنفس العنصر. نظراً لأنّ النيوترونات لا تحمل شحنة موجبة، فإن تأثيرها ينحصر في الكتلة. على سبيل المثال، نظائر الكربون تختلف في كتلتها استناداً على عدد النيوترونات، رغم امتلاكها نفس الخواص الكيميائية.
في الجمع، العدد الكتلي لذرة يتحدد من مجموع عدد البروتونات والنيوترونات، مما يساعد في تحديد كافة الخصائص الفيزيائية للذرة بما فيها الوزن الذي يُعتبر خاصية جوهرية في الكثير من التطبيقات العلمية والعملية.





